Как удалить ржавчину с металла в домашних условиях: средства для очистки
Без антикоррозийного покрытия металл со временем начинает ржаветь. Для удаления ржавчины с металла в домашних условиях, используют не только механические, но и химические, электрохимические способы. Расскажем подробно о каждом из них.
Азотной кислотой
Слабо концентрированный 58-процентный раствор вполне можно приобрести без наличия каких-либо разрешающих документов в отделах, торгующих химреактивами.
Убрать ржавчину с помощью азотной кислоты можно за считанные минуты. Для обработки металла ее разводят до 10%. Но кислота способна травить и сам металл. Поэтому для проведения подобных экспериментов требуется определенный опыт.
Концентрацию раствора, предназначенного для удаления ржавчины, необходимо будет точно рассчитать в зависимости от количества металла. Проследить понадобится и за процессом: как только кислота прореагирует с окисью, может начаться процесс разложения металла. Плюс при работе с подобными растворами требуется наличие качественной вытяжки и неукоснительное соблюдение техники безопасности.

Так как кислота способна разъедать не только ржавчину, но и металл, для обработки металлорежущих инструментов (к примеру, плашек, метчиков) подобный способ не подойдет. Диаметр резьбы может существенно поменяться. Особенно опасны кислоты для углеродистых сталей. Чем больше в них углерода, тем сильнее будет поврежден металл.
Соляной кислотой
Она действует так же быстро, как и азотная. Металл начинает белеть буквально на глазах. Так как в процессе реакции выделяются опасные газы, подходить слишком близко к емкости, в которой проводится обработка, не следует.
Более медленным, но и самым безопасным способом очистки является смешивание кислоты с мукой. Ее добавление существенно снизит скорость травления металла. Правда, для снятия ржавчины понадобится больше времени. Можно попробовать также добавить в солянку уротропин, являющийся ингибитором (подавителем) коррозии.
При обработке любой из кислот для нейтрализации ее остатков изделие обязательно промывают в нашатырном спирте или слабом щелочном растворе соды, мыла. Учтите, что после удаления маслянистой пленки металлическое изделие может буквально в течение получаса вновь «порыжеть». Поэтому после очистки средством против ржавчины его необходимо сразу же протереть насухо или хорошо прокалить, чтобы вода полностью испарилась.

Затем деталь смазывают, покрывают слоем цинка или окрашивают. Если нет возможности в ближайшее время обработать металл антикоррозийным составом, его покрывают с помощью пульверизатора смесью литола (солидола) и бензина.
Ортофосфорной кислотой
Подобный способ является, пожалуй, самым распространенным и безопасным. Ведь ортофосфорная кислота не удаляет слой окиси, а превращает его в пленку, которая может служить антикоррозийным покрытием. Однако подобный метод годится лишь для изделий из металла, лишь чуть затронутой ржавчиной.
В продаже есть специальное средство, именуемые «Антиржавчиной». Оно изготавливается именно на основе ортофосфорной кислоты. Правда, действует подобный раствор чуть медленнее.
Если налет достаточно большой, лучше использовать комбинацию первого и второго способа. Вначале обработать деталь соляной кислотой, а с помощью фосфорной лишь зафиксировать результат.
Уксусом или лимонкой
Удалить ржавчину с металла можно даже с помощью этих кислот. Способ очистки прост и безопасен. Металлическое изделие помещают в раствор лимонной кислоты (на 2,5 л воды будет достаточно пары 20-граммовых пакетиков). Большие поверхности обрызгивают пульверизатором.
Время выдержки зависит от степени повреждения металла. Как правило, оно составляет не больше суток. Можно поступить по-другому. Выдержать деталь в растворе пару часов, а затем размягченный слой потереть металлическим ершиком или фольгой. Он легко отойдет. Для ускорения процесса раствор лимонной кислоты можно предварительно вскипятить.
Еще одним преимуществом обработки лимонной кислотой является возможность дальнейшей оцинковки без предварительной очистки. На фосфатную же пленку, образующейся в результате взаимодействия «ржи» с ортофосфатной кислотой, цинк не ляжет. Плюсом является и то, что лимонка не затрагивает лакированные или окрашенные покрытия.
Обработка с помощью уксуса осуществляется точно также. Чем больше его концентрация, тем лучше. Можно использовать даже 70-процентный его раствор. При добавлении к уксусу обычной соли (ее насыпают столько, чтобы она перестала растворяться) эффект усилится. Если слой налета большой, перед тем, как очистить ржавчину с помощью кислоты, поверхность можно обработать железной щеткой или наждачкой.

Щелочным раствором
Со сталью способны вступать в реакцию практические все кислоты, в том числе и лимонная. Щелочи же с ней абсолютно не взаимодействует. Если поместить металлическую деталь в кипящий 40-процентный раствор гидроксида калия или титрированного NaOН, слой окиси исчезнет полностью, а сталь не повредится.
Керосином и соляркой
С нашей точки зрения, это не только лучшие, но и самые безопасные средства от ржавчины. Правда, очистка металла будет более продолжительной по времени.
Покрытую ржавчиной деталь помещают на 5-7 дней в керосин или солярку. После такого вымачивания окись растворится полностью, а сам металл останется целым.
С помощью электролиза в кальцинированной соде
Подобная обработка позволяет сохранить в целостности даже хромированные поверхности. С помощью кальцинированной соды мы получим угольную кислоту, которая будет очищать металл.
Расскажем, как очистить металл от ржавчины подобным способом:
- При изготовлении небольшого количества раствора блоком питания может служить даже старая зарядка для телефона. Для обработки значительного объема деталей можно взять, к примеру, старый блок питания от компьютера.
- К обрабатываемой детали необходимо подключить минус, а к электроду плюс.
- Для лучшей проводимости участок, к которому будет подсоединяться провод, необходимо очистить наждачкой.
- В качестве положительного электрода используют подходящий по размеру кусок жести.
- За 3-4 часа такой обработки можно удалить даже значительные слои окиси железа. При необходимости электролиз проводят повторно.
- Остатки ржавчины можно протравить в растворе уксуса.
Избавиться от ржавчины в домашних условиях можно любым из вышеописанных способов. Для обработки крупных деталей допустимо использование кислот. Очистка подобным способом металлорежущих инструментов и деталей механизмов во избежание травления металла недопустима. Их лучше подвергнуть электролизу или поместить в раствор с керосином или соляркой.
Проверенные лайфхаки, как легко удалить ржавчину с металлической поверхности
Разных способов удаления ржавчины с металла существует огромное количество, только вот не все они работают так, как этого хотелось бы. Мы расскажем о проверенных лайфхаках, которые помогут в считанные минуты избавиться от ржавчины.
Важно! Как правило, средства, работающие со ржавчиной, всегда очень токсичны, так что обязательно надевайте перчатки, а при возможности – респиратор и защитные очки. Ожог на слизистых при несоблюдении техники безопасности может появиться чуть ли не мгновенно.
Откуда появляется ржавчина
Чтобы знать, как бороться со ржавчиной, нужно знать, откуда этот «враг» берется. Ржавчина может появиться на любой металлической поверхности, причем «недооценивать» ее не стоит: эта проблема может привести к тому, что от металлических предметов, ею пораженных, придется полностью избавиться.
Ржавчина может появиться только при участии воды или влажного воздуха. В таких условиях молекулы железа вступают в реакцию с молекулами кислорода, иными словами, железо окисляется. Чтобы этого избежать, поверхность обрабатывают антикоррозийным покрытием. Если этого сделано не было, ржавчину можно удалить – для этого есть большое количество разных способов.
Все перечисленные ниже методы помогут избавиться от ржавчины любого характера абсолютно на любом предмете, будь то какая-то металлическая деталь, корпус автомобиля, запчасть, сетка, труба, нож или что-либо еще.
 Способы ниже помогут избавиться от ржавчины на любом предмете
Способы ниже помогут избавиться от ржавчины на любом предметеЛучшие способы удаления ржавчины
Керосин
Керосин тоже неплохо справляется с такой «напастью». Ржавчину тоже сначала зачищают или металлической щеткой, или «наждачкой», а поверх протирают тряпкой, которая была обильно смочена в керосине. Можно поместить металлический предмет, покрытый ржавчиной, в емкость с керосином. Таким же образом можно и машинное масло использовать, но оно будет немного слабее.
Рассмотрим, как правильно очищать металл от ржавчины таким способом.
| Иллюстрация | Описание |
|---|---|
 | Есть металлическая велосипедная цепь, покрытая ржавчиной после долгого использования. Ее и предстоит очистить с помощью керосина. |
 | Чтобы избавиться от ржавчины, будет использоваться технический керосин (200 мл). Также необходимо заготовить еще одну емкость – банку или, как в данном случае, пластиковую бутылку |
 | Цепь была помещена в бутылку, куда затем был залит керосин. Рекомендуется, чтобы он покрыл все металлические части полностью – так избавиться от ржавчины получится быстрее. Далее всё просто: бутылку нужно хорошенько потрясти, а затем оставить на некоторое время – от 10 минут до 2-3 часов: все зависит от того, насколько заржавел предмет. |
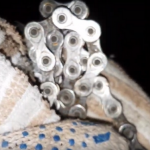 | Спустя указанное время металлическую цепь достали. Результат приятно поражает: ржавчина была удалена практически полностью, а керосин стал черным. |
Важно! Может случиться такое, что ржавчина не удалится полностью, если ее на металле было очень много. В таком случае процедуру стоит повторить еще раз – тогда от нее точно ни следа не останется.
Автоочиститель
Такое средство можно купить в любом магазине автомобильных товаров. Перед использованием автоочистителя лучше зачистить металлическую поверхность жесткой щеткой, а затем нанести средство толстым слоем – в 3-4 мм. Оставьте его на пару минут, а затем удалите остатки средства вместе со ржавчиной влажной тряпкой. Можно повторить такую процедуру несколько раз, если сразу удалить ржавчину не вышло.
 Чтобы избавиться от коррозии, можно использовать обычный автоочиститель
Чтобы избавиться от коррозии, можно использовать обычный автоочистительСоляная или серная кислота
Если у вас есть соляная или серная кислота, воспользоваться ею для удаления ржавчины – отличное решение. В кислоту нужно добавить уротропин, который и будет подавлять процесс образования коррозии, удаляя уже появившуюся ржавчину.
Состав средства:
- 5-процентный раствор кислоты – 400 мл;
- 0,5 грамма уротропина.
Полученным средством заливают или аккуратно обрабатывают с помощью кисти «пораженный» участок металла. Если у вас нет уротропина (который является ингибитором), то чисто кислотой пользоваться нельзя – она просто разрушит металл.
 Хорошо избавляет от коррозии серная или соляная кислота
Хорошо избавляет от коррозии серная или соляная кислотаЕще проще, если коррозией были поражены мелкие металлические детали. Их нужно забросить в такой же по концентрации раствор буквально на 5-10 минут, а потом аккуратно достать и насухо вытереть. От ржавчины не останется ничего.
Кстати! Вместо уротропина можно использовать приготовленный своими руками ингибитор из картофельной ботвы. Для этого банку наполовину заполняют ботвой, заливают ее до середины соляной или хлористоводородной кислотой, в течение следующих 20-ти минут постоянно помешивают, а затем используют как ингибитор.
Рассмотрим пример правильного очищения металла от ржавчины таким способом.
| Иллюстрация | Описание |
|---|---|
 | В первую очередь для очищения металлический деталей от ржавчины нужно приготовить емкости. В первой – соляная кислота и уротропин, во второй – 2 чайные ложки соды, смешанные со стаканом воды. |
 | Перед тем, как погрузить деталь в емкость, ее нужно почистить с помощью щетки или железной щетки. Это упростит процесс удаления ржавчины. |
 | В первую очередь деталь нужно погрузить в емкость с соляной кислотой – минут на 5-10, в зависимости от того, насколько «поражен» металл. Помните, что работать лучше в перчатках, а погружать деталь обязательно пинцетом! |
 | Спустя указанное время деталь перекладывают в емкость с водой и содой на 30-60 секунд, а затем насухо вытирают. |
 | Конечно, следы поражения останутся, если металл давно разъедается, но вот самого «врага» в виде ржавчины не останется. Таким образом можно успешно очищать любые металлические предметы. |
Видео – Как работает соляная кислота со ржавчиной
Фосфорная кислота
Хорошо подойдет и фосфорная кислота. 15% или 30% раствор наносят на ржавчину с помощью кисти или пульверизатора, оставляют до высыхания, а затем легко удаляют ржавчину с поверхности.
Можно сделать и раствор:
- 1 л фосфорной кислоты;
- 15 мл винной кислоты;
- 5 мл бутанола.
Такое средство будет еще более сильным в борьбе со ржавчиной. Наносится аналогичным способом.
 Можно использовать и фосфорную кислоту
Можно использовать и фосфорную кислотуРастворы от ржавчины своими руками
Есть несколько рецептов средств от ржавчины, которые легко приготовить даже своими руками! Вот наиболее эффективные, проверенные нами лично.
- Раствор из формалина. Для его приготовления смешивают 300 мл воды, 50 г едкого натра, 50 г аммония и 250 г формалина (40%). Полученный раствор разбавляют еще в одном литре воды. В него помещают металлические детали или обрабатывают им металл, покрытый ржавчиной. Обычно нужно не больше 35 минут, чтобы увидеть эффект. Рекомендуется после процедуры промывать металл горячей водой, а затем вытереть насухо. Блестеть будет как новенький.
- Смесь из 100 г жидкого парафина и 50 г молочной кислоты. Кислота сначала превратит ржавчину в соль, а затем та растворится в парафине. Работает безотказно и очень быстро. По окончании процедуры протрите поверхность металла сухой тряпкой.
 Можно протереть металл, покрытый ржавчиной, жидким парафином и молочной кислотой
Можно протереть металл, покрытый ржавчиной, жидким парафином и молочной кислотой - Смочите покрытый ржавчиной металл скипидаром или керосином. Это поможет легко удалить ржавчину, а еще отвернуть гайку, которая приржавела.
- Смесь серной кислоты и цинка. На 50 мл кислоты нужно несколько граммов цинка, и раствор готов – можно обрабатывать им металл. Правда, работает он долго – снимать ржавчину можно только примерно через сутки.
Эти средства очень эффективны, но, чтобы их приготовить, все же придется раздобыть ингредиенты. Однако можно использовать и подручные домашние средства. Это и более безопасно, и не менее эффективно. Ингредиенты для таких средств точно есть в каждом доме.
Подручные средства для избавления от ржавчины
- Уксус и лимонный сок. Оба компонента смешивают в одинаковых частях и аккуратно наносят на ржавчины – с помощью губки, тряпки или кисти. С металла такое средство удалит ржавчину за несколько часов. Спустя это время нужно потереть ржавчину металлической щеткой, вымойте это место чистой водой, а затем вытрите насухо.
- Рыбий жир. Удивительно, но рыбий жир тоже помогает избавиться от ржавчины! Жир избавляет от коррозии очень быстро, а на металле останется тоненькая пленка, которая не даст ржавчине образоваться вновь. Просто раздавите несколько капсул и нанесите их на ржавчину.
 Удивительно, но даже обычный рыбий жир может избавить от коррозии
Удивительно, но даже обычный рыбий жир может избавить от коррозии - Сода. В борьбе со ржавчиной может помочь обычная пищевая сода. Добавьте в нее немного воды, чтобы смесь оказалось густой, а затем нанесите ее на те участки металла, где есть ржавчина. Оставьте на полчаса-час, а затем потрите эти места металлической
- Кетчуп. Удивительно, но вам легко может избавить от ржавчины обычный кетчуп или даже томатный сок! Обильно нанесите на место ржавчины сок или кетчуп, оставьте на пару часов, а затем хорошенько промойте это место. Вы будете поражены, но ржавчина удалится не хуже, чем от серной кислоты.
- «Алказельтцер». Вы наверняка видели или даже пользовались популярным средством от похмелья «Алказельтцер». Нужно растворить в небольшом количестве воды (до 500 мл) таблетку такого препарата, а затем обработайте полученным средством места со ржавчинами или поместите в раствор все металлические предметы, которые подверглись коррозии. Хватит пары часов «работы» средства. Главное – не забудьте потом хорошо просушить металл.
 Можно использовать даже «Алказельтцер» — он тоже прекрасно удаляет ржавчину
Можно использовать даже «Алказельтцер» — он тоже прекрасно удаляет ржавчинуА вот пошаговая инструкция очищения от ржавчины металла с помощью уксусной и лимонной кислот – это тоже сделать очень просто.
| Иллюстрация | Описание |
|---|---|
 | В данном случае от ржавчины нужно очистить два «блина». Чтобы провести эксперимент, один положим в разбавленную лимонную кислоту (1 пакет на 20 г заливают 300 мл воды), а второй – в уксусную (9%, 300 мл). Предварительно очищать металл никак не надо. К сожалению, способ этот довольно долгий, и это его главный минус – чтобы увидеть эффект, придется подождать 12-24 часа. |
 | Достанем в первую очередь блин из емкости с уксусной кислотой. Обратим внимание на то, что он покрылся чем-то черным – это грязь, которая просто поднялась на поверхность. |
 | Уксусная кислота хорошо удалила ржавчину, но все же не полностью – некоторая «чернота» все же осталась. Можно сделать вывод, что уксус работает, но лучше его использовать, когда металл «поражен» не слишком сильно. |
 | Теперь рассмотрим блин, который находился в растворе лимонной кислоты. Удивительно, но от ржавчины вообще ничего не осталось: блин выглядит почти как новый. Так что вполне ясно, что этот способ работает несколько лучше. |
Как видно, способов избавления от ржавчины очень много – есть и довольно сложные, а есть и максимально простые, которые вполне осуществимы в домашних условиях даже без дополнительных покупок разных «ингредиентов» смесей. Главное – что все эти методы проверены, причем и другими людьми, и экспертами нашего сайта. Выбирайте любой – точно не разочаруетесь!
Видео — Чем легко удалить раковину в домашних условиях
Как удалить ржавчину в бытовых условиях. Народные методы.
 Ржавчине (коррозии металла) подвержены изделия из железа и его сплавов, находящихся в неблагоприятной обстановке, такой как влажная середа, отсутствие на поверхности надежного защитного покрытия. Проявляется сначала в виде буроватого налета, который, если, его вовремя не удалить, может полностью привести деталь в непригодность.
Ржавчине (коррозии металла) подвержены изделия из железа и его сплавов, находящихся в неблагоприятной обстановке, такой как влажная середа, отсутствие на поверхности надежного защитного покрытия. Проявляется сначала в виде буроватого налета, который, если, его вовремя не удалить, может полностью привести деталь в непригодность.
Препараты и материалы, используемые для очистки ржавчины.
Препараты, способствующие удалению ржавчины, можно условно разделить на специальные и обычно применяемые в быту. К первой группе относятся, в частности, различного рода растворители и преобразователи ржавчины, соляная, серная и фосфорная кислоты, чистящие пасты, содержащие абразивные и кислотные наполнители. Ко второй — лимонная и щавелевая кислоты, столовый укус, сода пищевая, рыбий жир и даже обычный картофель и газированные напитки типа кока-колы. Какой конкретно материал выбрать, зависит от Вас, но при этом следует иметь в виду то обстоятельство, что они различаются и по эффективности, и по скорости воздействия. Например, серная кислота удаляет ржавчину медленнее соляной, фосфорная кислота – еще медленнее, но при этом на поверхности образовывается защитная пленка, которая в дальнейшем будет в определенной степени препятствовать проявлению ржавчины.
Материалы: проволочная щетка по металлу, наждачная бумага, для снятия рыхлых пластов ржавчины используют скребок или шпатель. При наличии дрели можно использовать особые проволочные или абразивные насадки. Вспомогательные средства: респиратор, защитные очки, резиновые перчатки, перед началом работы на руки можно нанести защитный крем.
Удаление ржавчины с металла в быту
Ржавчина с металла удаляется химическим или механическим способом, в особо сложных случаях их можно и нужно комбинировать.
Перед удалением ржавчины химическим способом первым делом нужно, при необходимости, очистить рыхлые и сыпучие слои скребком или шпателем, после чего тщательно обезжирить обрабатываемую поверхность. Для этого подойдет любой растворитель типа ацетона, чистый бензин или любое применяемое в быту моющее средство. При использовании моющих средств их остатки нужно хорошо вымыть водой.
Специальные средства:
Растворители и преобразователи ржавчины, это специальные средства, которые вступают в реакцию с продуктами коррозии. Различие в их воздействии заключается в том, что первые просто очищают металл от ржавчины, а вторые преобразуют ее в своеобразный защитный слой. Об окончании процесса свидетельствует изменение ее цвета с буроватого до фиолетового с серым оттенком. При использовании преобразователей необходимо учитывать то, что различные их виды неодинаково вступают в реакцию с продуктами коррозии, одни создают защитную пленку, другие превращают их в трудно растворимые соединения. Способы их применения указаны, как правило, на каждом препарате. Для предотвращения коррозии в дальнейшем на обработанную поверхность следует нанести лакокрасочное покрытие. Существует два противоположных мнения по поводу того, необходимо ли промывать обработанную поверхность перед покраской, наше мнение – делать это не обязательно, если начало этого процесса не слишком затянуто во времени. В то же время, если на поверхности остались сухие, легко отслаиваемые частички, их необходимо смести чистой щеткой.
Соляная кислота. Хорошо и сравнительно быстро удаляет ржавчину с поверхности металла, основной ее недостаток – в чистом виде активно воздействует на сам металл, поэтому в раствор добавляются ингибиторы, замедляющие скорость химической реакции. В этом качестве, кроме специальных препаратов, можно использовать столярный клей или уротропин. После обработки поверхность хорошо промывается водой.
Серная кислота. Менее агрессивно воздействует на металл, особенно углеродистую сталь, при этом эффективно воздействует на продукты коррозии. Можно использовать без добавления ингибиторов. При добавлении цинка растворенная ржавчина активно на нем оседает, поэтому поверхность легко очищается.
Фосфорная кислота. По отзывам специалистов при применении кислот очистка этим препаратом является самым безопасным способом. Преобразуя ржавчину, создает на поверхности защитную пленку обычно черного цвета, которая в определенной степени тормозит дальнейшее распространение коррозии металла.
Старая ржавчина удалить лучше всего специальными чистящими пастами. В состав паст, кроме моющих и абразивных веществ, входят и кислоты (соляная, серная, фосфорная и некоторые другие). При их покупке следует внимательно знакомиться с инструкцией по применению и выбирать тот товар, который необходим для выполнения определенного вида и объема работ.
Бытовые средства.
Лимонная кислота. Применяется при незначительных проявлениях ржавчины, в частности, на бытовых предметах – ножах, ножницах и т.п. Пораженные ржой предметы поместить на непродолжительное время в раствор кислоты или натереть соком лимона, после чего обильно промыть водой. При необходимости процедуру можно повторить до полного исчезновения ржавчины.
Щавелевая кислота. Бережно очищает от налета ржавчины, не повреждая при этом лакокрасочное покрытие. Применяется не только при очистке металлических поверхностей, но и фаянсовых и эмалированных изделий, выведении пятен ржавчины на ткани.
Картофель. В его структуру входит небольшое количество щавелевой кислоты, которая, как указано выше, хорошо способствует удалению ржавчины.
Столовый уксус. Предмет, который необходимо обработать, погружается в раствор на несколько часов (в зависимости от степени коррозии), после чего тщательно промывается и насухо вытирается. Удалить ржавчину уксусной кислотой в таком случае конечно эффективнее и быстрее, чем просто 9% уксусом.
Сода пищевая. Смешивается с водой до пастообразного состояния, после чего наносится на пятна ржавчины и выдерживается практически до полного высыхания, аккуратно очищается щеткой, промывается водой и высушивается.
Нашатырный спирт и перекись водорода. Из указанных препаратов необходимо сделать раствор концентрацией 2 к 1, при этом перекись водорода необходимо добавлять в нашатырный спирт небольшими дозами. Этот раствор следует готовить в стеклянной таре, тщательно перемешивая его. Устраняет следы ржавчины не только на металлических, но и на эмалированных поверхностях.
Рыбий жир. Нанести на поверхность тонким слоем, через несколько часов ржавчина легко удалится. Проникая на всю глубину поврежденного слоя, образует защитную пленку, затрудняющую дальнейшее распространение ржавчины. Учитывая стойкий специфический запах, предпочтительнее обрабатывать этим препаратом металлические предметы, которые постоянно находятся вне помещений.
Кока-кола. В состав входит небольшое количество ортофосфорной кислоты, поэтому помещенный в раствор корродированный предмет примерно за сутки полностью очистится от ржавчины.
При выполнении работ по очистке металлически предметов от ржавчины используемые кислоты, уксус, нашатырный спирт и некоторые другие препараты выделяют едкие пары, опасные для здоровья человека. Вследствие этого проводить их нужно в хорошо проветриваемом помещении, желательно нежилом, с соблюдением всех правил техники безопасности и использованием индивидуальных средств защиты (респиратора, очков, перчаток, при необходимости – иных).
На завершающем этапе для предотвращения дальнейшего развития коррозии металла, поврежденные места нужно после тщательной просушки обработать хотя бы машинным маслом.
Почему проявляются пятна ржавчины на бетоне
Основной причиной появления ржавчины на поверхности бетона вследствие коррозии арматуры. В качественно изготовленной бетонной конструкции арматура, теоретически, ржаветь не может. Но если с Вами приключилась такая беда, есть несколько путей от нее избавиться. Основной из них, наиболее радикальный, но и самый действенный, — добраться до источника загрязнения и ликвидировать его. Для этого нужно на месте появления ржавчины продолбить в бетоне желобок на глубину, позволяющую освободить арматуру самое меньшее на половину ее диаметра и по всей длине, подверженной коррозии. После этого — обработать металл любым доступным Вам химическим или механическим способом до полного его очищения, нанести на него антикоррозийное покрытие, при этом можно использовать олифу, герметик, краску, но не на водной основе, дать им хорошо просохнуть, затем зашпаклевать желобок.
Другой способ – обработать места проявления ржавчины на бетоне медным купоросом, который обладает не только защитными, но и бактериальными свойствами. Обработку можно провести как чистым раствором этого препарата, так и с его использованием при изготовлении своеобразной грунтовки. Для этого необходимо 50 г медного купороса развести в стакане воды, затем такое же количество столярного клея и натертого на мелкую терку хозяйственного мыла растворить отдельно в половине литра воды, добавив небольшое количества. Оба раствора совместить и хорошо перемешать. Полученной шпаклевкой тщательно обработать поверхности бетона, подверженные ржавлению. В случае, если самостоятельное приготовление такого раствора затруднительно, подобного рода шпаклевки можно приобрести в специализированной торговой сети, где они представлены в широком ассортименте.
Удаление пятен ржавчины с ткани
Природа появления пятен ржавчины на ткани разнообразна и порой неожиданна. Это и забытые в карманах влажной одежды металлические предметы, и некачественная фурнитура (пуговицы, молнии заклепки). Но наиболее распространенное явление – длительное или интенсивное соприкосновение с предметами, подверженными коррозии (например, сушка белья на металлической проволоке, имеющей хотя бы незначительные проявления ржавчины, ребенок проехал с горки, поверхность которой имеет такие же пороки).
Старая ржавчина удалить загрязнение на ткани можно с помощью различных пятновыводителей, содержащих, как правило, щавелевую или уксусную кислоту. При их выборе нужно учитывать интенсивность загрязнения, «старость» пятен (чем дольше пятно ржавчины находится на ткани, тем труднее его вывести), состав очищаемых тканей (вискоза, шерсть, цветные или белые). К окрашенным тканям нельзя применять пятновыводители, содержащие хлор, так как вместе с пятном может исчезнуть и краска на ткани. Однако, если рядом таких специальных препаратов нет, можно использовать средства домашнего обихода, которые практически всегда есть под рукой.
Старая ржавчина удалить с ткани можно с помощью:
- пищевой соды, смешанной в одинаковых пропорциях с лимонной кислотой или соком лимона, хорошо нагретую смесь нанести на загрязненное место, минут через десять тщательно прополоскать;
- глицерина жидкого и порошка мела, смешанные в равных соотношениях до густоты сметаны, нанести на пятно и оставить примерно на сутки, после чего постирать в обычном режиме;
- глицерина жидкого с добавлением моющего средства типа «FAIRY”, смешать в одинаковых объемах, нанести на пятно, через некоторое время обильно промыть водой;
- спиртового уксуса, разведенного в горячей воде, в раствор опустить участок загрязненной ткани примерно 2 – 3 минуты, после чего прополоскать в воде с добавлением небольшого количества нашатыря;
- обычной поваренной соли, растворенной в столовом уксусе, смешать в равных пропорциях, нанести на загрязненное место и оставить до получаса, после чего промыть водой с помощью хозяйственного мыла.
В любом случае, перед началом выведения пятен необходимо проверить реакцию ткани и красителя на используемый препарат в малоприметном месте, чтобы убедиться, что он не нанесет еще больший вред. Ни в коем случае нельзя применять средства, содержащие хлор, который не только не выведет ржавчину, но и навредит ткани.
Ржавчина — Википедия
 Цвет ржавчины
Цвет ржавчиныРжа́вчина — является итогом окисления металла. А так же, общим термином для определения оксидов железа. В разговорной речи это слово применяется к красным оксидам, образующимся в ходе реакции железа с кислородом в присутствии воды или влажного воздуха. Есть и другие формы ржавчины, например, продукт, образующийся в ходе реакции железа с хлором при отсутствии кислорода. Такое вещество образуется, в частности, в арматуре, используемой в подводных бетонных столбах, и называют его зелёной ржавчиной. Несколько видов коррозии различимы зрительно или с помощью спектроскопии, они образуются при разных внешних условиях.[1] Ржавчина состоит из гидратированного оксида железа(III) Fe2O3·nH2O и метагидроксида железа (FeO(OH), Fe(OH)3). При наличии кислорода, воды и достаточного времени любая масса железа в конечном итоге преобразуется полностью в ржавчину и разрушается. Поверхность ржавчины не создаёт защиту для нижележащего железа, в отличие от образования патины на медной поверхности.
Ржавчиной, как правило, называют продукт коррозии только железа и его сплавов, таких как сталь. Многие другие металлы тоже подвергаются коррозии, но именно оксиды железа обычно называют ржавчиной.
 Толстый слой ржавчины на звеньях цепи возле моста Золотые Ворота в Сан-Франциско. Цепь постоянно подвергается воздействию сырости и солёных брызг, вызывающих разрушение поверхности, растрескивание и шелушение металла.
Толстый слой ржавчины на звеньях цепи возле моста Золотые Ворота в Сан-Франциско. Цепь постоянно подвергается воздействию сырости и солёных брызг, вызывающих разрушение поверхности, растрескивание и шелушение металла.Причины ржавления[править | править код]
Если железо, содержащее какие-либо добавки и примеси (например, углерод), находится в контакте с водой, кислородом или другим сильным окислителем и/или кислотой, то оно начинает ржаветь. Если при этом присутствует соль, например, имеется контакт с солёной водой, коррозия происходит быстрее в результате электрохимических реакций. Чистое железо относительно устойчиво к воздействию чистой воды и сухого кислорода. Как и у других металлов, например, у алюминия, плотно приставшее оксидное покрытие на железе (слой пассивации) защищает основную массу железа от дальнейшего окисления. Превращение же пассивирующего слоя оксида железа в ржавчину является результатом комбинированного действия двух реагентов, как правило, кислорода и воды. Другими разрушающими факторами являются диоксид серы и углекислый газ в воде. В этих агрессивных условиях образуются различные виды гидроксида железа. В отличие от оксидов железа, гидроксиды не защищают основную массу металла. Поскольку гидроксид формируется и отслаивается от поверхности, воздействию подвергается следующий слой железа, и процесс коррозии продолжается до тех пор, пока всё железо не будет уничтожено, или в системе закончится весь кислород, вода, диоксид углерода или диоксид серы.[2]
Происходящие реакции[править | править код]
 Покрытый ржавчиной и грязью болт. Заметна точечная коррозия и постепенная деформация поверхности, вызванная сильным окислением.
Покрытый ржавчиной и грязью болт. Заметна точечная коррозия и постепенная деформация поверхности, вызванная сильным окислением.Ржавление железа — это электрохимический процесс, который начинается с переноса электронов от железа к кислороду.[3] Скорость коррозии зависит от количества имеющейся воды, и ускоряется электролитами, о чём свидетельствуют последствия применения дорожной соли на коррозию автомобилей. Ключевой реакцией является восстановление кислорода:
- O2 + 4 e− + 2 H2O → 4 OH−
Поскольку при этом образуются гидроксид-анионы, этот процесс сильно зависит от присутствия кислоты. Действительно, коррозия большинства металлов кислородом ускоряется при понижении pH. Обеспечение электронов для вышеприведённой реакции происходит при окисления железа, которое может быть описано следующим образом:
- Fe → Fe2+ + 2 e−
Следующая окислительно-восстановительная реакция происходит в присутствии воды и имеет решающее значение для формирования ржавчины:
- 4 Fe2+ + O2 → 4 Fe3+ + 2 O2−
Кроме того, следующие многоступенчатые кислотно-щелочные реакции влияют на ход формирования ржавчины:
- Fe2+ + 2 H2O ⇌ Fe(OH)2 + 2 H+
- Fe3+ + 3 H2O ⇌ Fe(OH)3 + 3 H+
что приводит к следующим реакциям поддержания баланса дегидратации:
- Fe(OH)2 ⇌ FeO + H2O
- Fe(OH)3 ⇌ FeO(OH) + H2O
- 2 FeO(OH) ⇌ Fe2O3 + H2O
Из приведённых выше уравнений видно, что формирование продуктов коррозии обусловлено наличием воды и кислорода. С ограничением растворённого кислорода на передний план выдвигаются железо(II)-содержащие материалы, в том числе FeO и чёрный магнит (Fe3O4). Высокая концентрация кислорода благоприятна для материалов с трёхвалентным железом, с номинальной формулой Fe(OH)3-xOx/2. Характер коррозии меняется со временем, отражая медленные скорости реакций твёрдых тел.
Кроме того, эти сложные процессы зависят от присутствия других ионов, таких как Ca2+, которые служат в качестве электролита, и таким образом, ускоряют образование ржавчины, или в сочетании с гидроксидами и оксидами железа образуют различные осадки вида Ca-Fe-O-OH.
Более того, цвет ржавчины можно использовать для проверки наличия ионов Fe2+, которые меняют цвет ржавчины с жёлтого на синий.
 Отслаивающаяся краска обнажает участки ржавой поверхности листового металла.
Отслаивающаяся краска обнажает участки ржавой поверхности листового металла.Ржавчина является проницаемой для воздуха и воды, поэтому внутрилежащее железо продолжает разъедаться. Предотвращение ржавчины, следовательно, требует покрытия, которое исключает образование ржавчины. На поверхности нержавеющей стали образуется пассивирующий слой оксида хрома(III). Подобное проявление пассивации происходит с магнием, титаном, цинком, оксидом цинка, алюминием, полианилином и другими электропроводящими полимерами.
Гальванизация[править | править код]
Хорошим подходом к предотвращению ржавчины является метод гальванизации, который обычно заключается в нанесении на защищаемый объект слоя цинка либо методом горячего цинкования, либо методом гальванотехники. Цинк традиционно используется, потому что он достаточно дёшев, обладает хорошей адгезией к стали и обеспечивает катодную защиту на стальную поверхность в случае повреждения цинкового слоя. В более агрессивных средах (таких, как солёная вода), предпочтительнее кадмий. Гальванизация часто не попадает на швы, отверстия и стыки, через которые наносилось покрытие. В этих случаях покрытие обеспечивает катодную защиту металла, где оно выступает в роли гальванического анода, на который прежде всего и воздействует коррозия. В более современные покрытия добавляют алюминий, новый материал называется цинк-алюм. Алюминий в покрытии мигрирует, покрывая царапины и, таким образом, обеспечивая более длительную защиту. Этот метод основан на применении оксидов алюминия и цинка, защищающих царапины на поверхности, в отличие от процесса оксидизации, как в случае применения гальванического анода. В некоторых случаях при очень агрессивных средах или длительных сроках эксплуатации применяются одновременно и гальванизация цинком, и другие защитные покрытия, чтобы обеспечить надёжную защиту от коррозии.
Катодная защита[править | править код]
Катодная защита является методом, используемым для предотвращения коррозии в скрытых под землёй или под водой структурах путём подачи электрического заряда, который подавляет электрохимические реакции. Если её правильно применять, коррозия может быть остановлена полностью. В своей простейшей форме это достигается путём соединения защищаемого объекта с протекторным анодом, в результате чего на поверхности железа или стали происходит только катодный процесс. Протекторный анод должен быть сделан из металла с более отрицательным электродным потенциалом, чем железо или сталь, обычно это цинк, алюминий или магний.
Лакокрасочные и другие защитные покрытия[править | править код]
От ржавчины можно предохранять с помощью лакокрасочных и других защитных покрытий, которые изолируют железо из окружающей среды. Большие поверхности, поделённые на секции, как например, корпуса судов и современных автомобилей, часто покрывают продуктами на основе воска. Такие средства обработки содержат также ингибиторы коррозии. Покрытие стальной арматуры бетоном (железобетон) обеспечивает некоторую защиту стали в среде с высоким рН. Однако коррозия стали в бетоне всё ещё является проблемой.
Покрытие слоем металла[править | править код]
Ржавчина может полностью разрушить железо. Обратите внимание на гальванизацию незаржавевших участков.- Оцинковка (оцинкованное железо/сталь): железо или сталь покрываются слоем цинка. Может использоваться метод горячего цинкования или метод цинкового дутья.
- Лужение: мягкая листовая сталь покрывается слоем олова. В настоящее время практически не используется из-за высокой стоимости олова.
- Хромирование: тонкий слой хрома наносится электролитическим способом на сталь, обеспечивая как защиту от коррозии, так и яркий, полированный внешний вид. Часто используется в блестящих компонентах велосипедов, мотоциклов и автомобилей.
Воронение[править | править код]
Воронение — это способ, который может обеспечить ограниченную устойчивость к коррозии для мелких предметов из стали, таких как огнестрельное оружие и др. Способ состоит в получении на поверхности углеродистой или низколегированной стали или чугуна слоя окислов железа толщиной 1-10 мкм. Для придания блеска, а также для улучшения защитных свойств окисной плёнки, её пропитывают минеральным или растительным маслом.
Снижение влажности[править | править код]
Ржавчины можно избежать, снижая влажность окружающего железо воздуха. Этого можно добиться, например, с помощью силикагеля.
Ингибиторы[править | править код]
Ингибиторы коррозии, как, например, газообразные или летучие ингибиторы, можно использовать для предотвращения коррозии в закрытых системах. Некоторые ингибиторы коррозии чрезвычайно ядовиты. Одним из лучших ингибиторов выступают соли технециевой кислоты.
Ржавчина вызывает деградацию изделий и конструкций, изготовленных из материалов на основе железа. Поскольку ржавчина имеет гораздо больший объём, чем исходное железо, её нарост ведёт к быстрому разрушению конструкции, усиливая коррозию на прилегающих к нему участках — явление, называемое поеданием ржавчиной. Это явление стало причиной разрушения моста через реку Мианус (штат Коннектикут, США) в 1983 году, когда подшипники подъёмного механизма полностью проржавели изнутри. В результате этот механизм зацепил за угол одной из дорожных плит и сдвинул её с опор. Ржавчина была также главной причиной разрушения Серебряного моста в Западной Вирджинии в 1967 году, когда стальной висячий мост рухнул меньше, чем за минуту. Погибли 46 водителей и пассажиров, находившихся в то время на мосту.
 Мост Кинзу после разрушения.
Мост Кинзу после разрушения.Мост Кинзу в штате Пенсильвания был снесён смерчем в 2003 году в значительной степени потому, что центральные опорные болты, соединяющие сооружение с землёй, проржавели, из-за чего мост держался лишь под действием силы тяжести.
Кроме того, коррозия покрытых бетоном стали и железа может вызвать раскалывание бетона, что создает серьёзные конструкторские трудности. Это один из наиболее распространённых отказов железобетонных мостов.
- ↑ Interview, David Des Marais (неопр.) (недоступная ссылка). Архивировано 13 ноября 2007 года.
- ↑ Holleman, A. F.; Wiberg, E. «Inorganic Chemistry» Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ Hubert Gräfen, Elmar-Manfred Horn, Hartmut Schlecker, Helmut Schindler «Corrosion» Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH: Weinheim, 2002. DOI: 10.1002/14356007.b01_08
Коррозия металлов в кислотах
Коррозия металла в кислотах – это его разрушение при взаимодействии с концентрированными или разведенными кислотами. Часто такие разрушения встречаются на химических производствах и других сферах деятельности человека. Слабые кислотные растворы могут создавать даже некоторые продукты питания, и непокрытый металл, соприкасающийся с ними, будет коррозировать. То, как себя поведет металлический предмет при контакте с кислотой, зависит от его способности пассивироваться. Процесс коррозии металлов в кислотах проходит с выделением водорода.
Рассмотрим более подробно случаи коррозии металла в кислотах разного происхождения.
Коррозия металлов в соляной кислоте
Соляная кислота является очень агрессивной по отношению к металлам. В большей степени это обуславливается содержанием в ней ионов Cl—. Даже коррозионно-стойкие стали подвергаются разрушению, когда концентрация кислоты выше среднего. Если же раствор достаточно сильно разбавлен, такие стали коррозии не подвергаются.
Коррозия никеля в серной кислоте не протекает даже в случаях, когда достигается температура кипения. В присутствии трехвалентного железа, хлоридов, других окислителей никель и его сплавы начинают разрушаться.
Низколегированная аустенитная сталь при комнатной температуре и концентрации соляной кислоты в 0,2 – 1% подвергается коррозии со скоростью 24 г/(м2•сут).
Коррозия металлов в органических кислотах
Самой сильной среди органических кислот является уксусная. В яблочной, бензойной, пикриновой, олеиновой, винной, стеариновой кислотах даже при больших температурах (выше 100°С) коррозионно-стойкие стали отличаются высокой устойчивостью. При контакте металлов с муравьиной кислотой образуются питтинги (особенно при увеличении температуры). Глубина их даже больше, чем в уксусной кислоте.
В органических кислотах высокой устойчивостью обладает алюминий, т.к. на его поверхности присутствует защитная пленка труднорастворимых окислов.
Щавелевая, себациновая, лимонная и молочная кислоты вызывают коррозию сталей только при больших концентрациях. В них устойчивы хромистые стали с добавками молибдена.
Коррозия металлов в азотной кислоте
Азотная кислота обладает агрессивным воздействием по отношению ко многим металлам. Малоуглеродистые стали не обладают достаточной устойчивостью в растворах азотной кислоты. Кроме того, при повышении концентрации HNO3 до 35 – 40% (при данных концентрациях сталь переходит в пассивное состояние) коррозия малоуглеродистых сталей в азотной кислоте увеличивается. При концентрации азотной кислоты близкой к 100% пассивное состояние нарушается. Азотная кислота является окислителем. При коррозии железа катодными деполяризаторами являются молекулы азотной кислоты и нитрат-ионы. Устойчивость в азотной кислоте хромистых сталей повышается, если в их состав вводить никель и молибден. Коррозионное разрушение сталей в азотной кислоте происходит по границам зерен. На алюминий слабое влияние оказывают пары азотной кислоты или растворы с концентрацией более 80%. При нормальной температуре алюминий обладает высокой коррозионной стойкостью в азотной кислоте. Скорость коррозии алюминия в азотной кислоте возрастает при постоянном перемешивании и присутствии в растворе хлорид-ионов.
Коррозия металлов в серной кислоте
При концентрации серной кислоты около 50 – 55% поверхность железа переходит в пассивное состояние. Далее с повышением температуры и концентрации серной кислоты поверхность железа становится активной (наблюдается коррозия железа в серной кислоте).
В растворах серной кислоты, как и в других кислотах, на скорость коррозии железа большое влияние оказывает природа анионов. Это связано с торможением катодного и анодного процессов и их адсорбцией на поверхности металла.
Я.М. Колотыркин развил представления, что на анодное растворение железа оказывают влияние анионы. Это связано с образование комплекса:
Fe + H2O ↔ Fe(OH—)адс. + H+;
Fe(OH—)адс ↔ Fe(OH)адс + e—;
Fe(OH)адс + HSO4— →FeSO4 + H2O + e—;
Fe(OH)адс + SO42- → FeSO4 + OH— + e—;
FeSO4 = Fe2+ + SO42-.
Из вышеперечисленных уравнений понятно, что скорость анодного процесса возрастает с увеличением концентрации ионов HSO4— и SO42-. С поверхности железа сульфат ионы вытесняются хлорид ионами, но до определенной концентрации ионов хлора, скорость протекания анодного процесса замедляется.
В 95 – 98% серной кислоте при нормальной температуре хорошей устойчивостью обладают хромистые стали (с содержанием хрома около 17%) с небольшой добавкой молибдена или без него. В таких условиях (при большой концентрации серной кислоты) стоек также алюминий и углеродистые стали. Чистый алюминий (99,5%) более устойчив в серной кислоте, чем его сплавы, в состав которых не входит медь. Скорость коррозии алюминия в серной кислоте (и его сплавов) при повышении температуры с 20°С до 98°С увеличивается с 8 до 24 г/(м2•сут). Коррозионно-стойкие стали в 5-ти или 20-% растворе при температуре кипения серной кислоты устойчивы только в присутствии ингибиторов коррозии.
При обычной температуре в серной кислоте коррозия меди практически не наблюдается. А при повышении температуры до 100°С процесс разрушения интенсифицируется. В 25% растворе серной кислоты, повышенном давлении и температуре близкой к 200°С медь быстро разрушается.
Латунь не обладает коррозионной стойкостью в растворах серной кислоты любых концентраций даже при комнатной температуре. Устойчивость латуней к разрушению в серной кислоте можно только повысить введением в раствор 30% соли CuSO4•5H2O.
Коррозия металлов в фосфорной кислоте
Наибольшей стойкостью к коррозии в фосфорной кислоте отличаются молибденовые стали. Алюминий и его сплавы (в состав которых не входит медь, магний) устойчивы в фосфорной кислоте. При обычной температуре не поддаются также разрушениям хромоникелевые аустенитные стали (в растворах фосфорной кислоты любой концентрации). В концентрированной технической фосфорной кислоте при температуре не выше 50°С стойки малоуглеродистые стали. Если сталь с 17% хрома поместить в раствор фосфорной кислоты, концентрацией от 1 до 10%, то она будет обладать высокой устойчивостью даже при температуре кипения.
Медь практически не подвергается коррозии в фосфорной кислоте при температуре от 20 до 95°С. Но если в систему вводить окислитель и повышать температуру – скорость коррозии меди в фосфорной кислоте значительно увеличивается. Бронзы и латуни в фосфорной кислоте ведут себя аналогично.
Коррозия металлов во фтористоводородной кислоте
Чугун, малоуглеродистая сталь и железо во фтористоводородной кислоте быстро разрушаются. В 10-% фтористоводородной кислоте при нормальной температуре обладают хорошей устойчивостью хромистые стали (с содержанием хрома 17%). В 20-% кислоте при температуре до 50°С устойчивы аустенитные высоколегированные стали. Латуни не разрушаются в 40-60-% фтористоводородной кислоте при 20°С. Магниевые сплавы устойчивы при температурах до 65°С в 45-% растворе.
Соляная кислота — одна из самых сильных кислот, чрезвычайно востребованный реактив
Соляная кислота — неорганическое вещество, одноосновная кислота, одна из  самых сильных кислот. Используются также другие названия: хлористый водород, кислота хлороводородная, кислота хлористоводородная.
самых сильных кислот. Используются также другие названия: хлористый водород, кислота хлороводородная, кислота хлористоводородная.
Свойства
Кислота в чистом виде представляет собой жидкость без цвета и запаха. Техническая кислота обычно содержит примеси, которые придают ей слегка желтоватый оттенок. Соляную кислоту часто называют «дымящей», так как она выделяет пары хлороводорода, вступающие в реакцию с влагой воздуха и образующие кислотный туман.
Очень хорошо растворяется в воде. При комнатной температуре максимально возможное по массе содержание хлороводорода —38%. Кислота концентрации большей 24% считается концентрированной.
Хлористоводородная кислота активно вступает в реакции с металлами, оксидами, гидроксидами, образуя соли — хлориды. HCl взаимодействует с солями более слабых кислот; с сильными окислителями и аммиаком.
Для определения соляной кислоты или хлоридов используют реакцию с нитратом серебра AgNO3, в результате которой выпадает белый творожистый осадок.
Техника безопасности
 Вещество очень едкое, разъедает кожу, органические материалы, металлы и их окислы. На воздухе выделяет пары хлороводорода, которые вызывают удушье, ожоги кожи, слизистой глаз и носа, повреждают органы дыхания, разрушают зубы. Соляная кислота относится к веществам 2 степени опасности (высокоопасным), ПДК реактива в воздухе составляет 0,005 мг/л. Работать с хлористым водородом можно только в фильтрующих противогазах и защитной одежде, включая резиновые перчатки, фартук, спецобувь.
Вещество очень едкое, разъедает кожу, органические материалы, металлы и их окислы. На воздухе выделяет пары хлороводорода, которые вызывают удушье, ожоги кожи, слизистой глаз и носа, повреждают органы дыхания, разрушают зубы. Соляная кислота относится к веществам 2 степени опасности (высокоопасным), ПДК реактива в воздухе составляет 0,005 мг/л. Работать с хлористым водородом можно только в фильтрующих противогазах и защитной одежде, включая резиновые перчатки, фартук, спецобувь.
При разливе кислоты ее смывают большим количеством воды или нейтрализуют щелочным растворами. Пострадавших от кислоты следует вынести из опасной зоны, промыть кожу и глаза водой или содовым раствором, вызвать врача.
Перевозить и хранить хим реактив допускается в стеклянной, пластиковой таре, а также в металлической таре, покрытой изнутри резиновым слоем. Тара должна герметично закрываться.
Получение
В промышленных масштабах соляную кислоту получают из газообразного хлороводорода (HCl). Сам хлороводород производится двумя основными способами:
— экзотермической реакцией хлора и водорода — таким образом получают реактив высокой чистоты, например, для пищевой промышленности и фармацевтики;
— из сопутствующих промышленных газов — кислота на основе такого HCl называется абгазной.
Это любопытно
Именно соляной кислоте природа «поручила» процесс расщепления пищи в организме. Концентрация кислоты в желудке составляет всего 0,4%, но этого оказывается достаточно, чтобы за неделю переварить бритвенное лезвие!
Кислота вырабатывается клетками самого желудка, который защищен от этой агрессивной субстанции слизистой оболочкой. Тем не менее, его поверхность обновляется ежедневно, чтобы восстановить поврежденные участки. Кроме участия в процессе переваривания пищи, кислота выполняет еще и защитную функцию, убивая болезнетворные микроорганизмы, попадающие в организм через желудок.
Применение
— В медицине и фармацевтике — для восстановления кислотности желудочного сока при его недостаточности; при анемии для улучшения всасываемости железосодержащих лекарств.
— В пищепроме это пищевая добавка, регулятор кислотности Е507, а также ингредиент сельтерской (содовой) воды. Используется при изготовлении фруктозы, желатина, лимонной кислоты.
— В химической промышленности — основа для получения хлора, соды,  глутамината натрия, хлоридов металлов, например, хлорида цинка, хлорида марганца, хлорида железа; синтеза хлорорганических веществ; катализатор в органических синтезах.
глутамината натрия, хлоридов металлов, например, хлорида цинка, хлорида марганца, хлорида железа; синтеза хлорорганических веществ; катализатор в органических синтезах.
— Больше всего производимой в мире хлористоводородной кислоты расходуется в металлургии для очистки заготовок от окислов. Для этих целей применяется ингибированная техническая кислота, в состав которой введены специальные ингибиторы (замедлители) реакции, благодаря чему реактив растворяет окислы, но не сам металл. Также соляной кислотой травят металлы; очищают их перед лужением, пайкой, гальванированием.
— Обрабатывают кожу перед дублением.
— В добывающей отрасли востребована для очистки буровых скважин от отложений, для обработки руд и горных пластов.
— В лабораторной практике хлористоводородная кислота используется как популярный реактив для аналитических исследований, для очистки сосудов от трудноудаляемых загрязнений.
— Применяется в каучуковой, целлюлозно-бумажной индустрии, в черной металлургии; для очистки котлов, труб, оборудования от сложных отложений, накипи, ржавчины; для очистки керамических и металлических изделий.
 Можно протереть металл, покрытый ржавчиной, жидким парафином и молочной кислотой
Можно протереть металл, покрытый ржавчиной, жидким парафином и молочной кислотой Удивительно, но даже обычный рыбий жир может избавить от коррозии
Удивительно, но даже обычный рыбий жир может избавить от коррозии