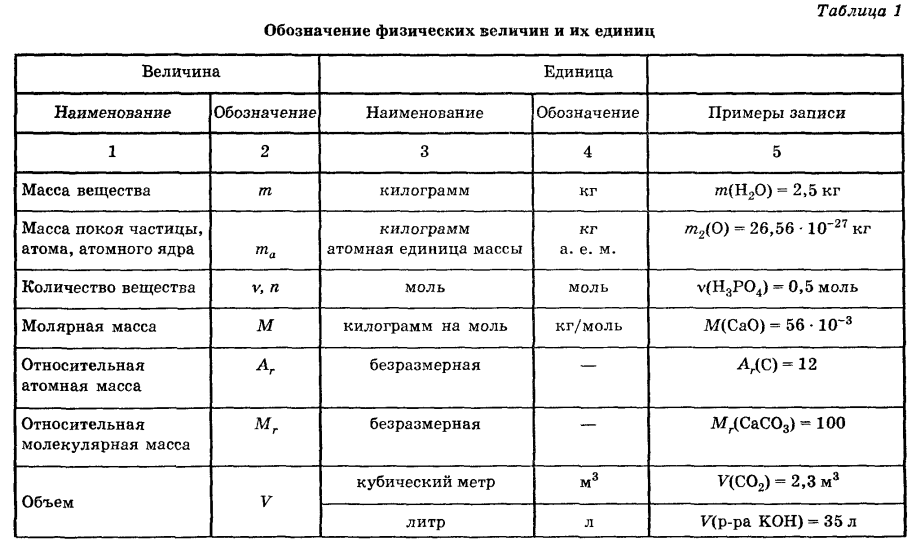
Обозначение L и N в электрике
Каждый раз, пытаясь подключить люстру или бра, датчик освещенности или движения, варочную панель или вытяжной вентилятор, терморегулятор теплого пола или блок питания светодиодной ленты, а также любое другое электрооборудование, вы можете увидеть следующие маркировки возле клемм подключения – L и N.
Давайте разберемся, о чем говорят обозначения L и N в электрике.
Как вы, наверное, сами догадались это не просто произвольные символы, каждый из них несет конкретное значение и выполняет роль подсказки, для правильного подключения электроприбора к сети.
« L » — Эта маркировка пришла в электрику из английского языка, и образована она от первой буквы слова «Line» (линия) – общепринятого названия фазного провода. Также, если вам удобнее, можно ориентироваться на такие понятия английских слов как Lead (подводящий провод, жила) или Live (под напряжением).
Соответственно обозначением L маркируются зажимы и контактные соединения, предназначенные для подключения фазного провода.
По современным стандартам (ГОСТ Р 50462-2009 (МЭК 60446:2007), действующим в России, цвета фазных проводов – коричневый или черный. Но зачастую, может встречаться белый, розовый, серый или провод любого другого цвета, кроме синего, бело-синего, голубого, бело-голубого или желто-зеленого.
«N» — маркировка, образованная от первой буквы слова Neutral (нейтральный) – общепринятое название нулевого рабочего проводника, в России называемого чаще просто нулевым проводником или коротко Ноль (Нуль). В связи с этим, удачно подходит английское слово Null (нулевой), можно ориентироваться на него.
Обозначением N в электрике маркируются зажимы и контактные соединения для подключения нулевого рабочего проводника/нулевого провода. При этом это правило действует как в однофазной, так и трехфазной сети.
Цвета провода, которыми маркируется нулевой провод (нуль, ноль, нулевой рабочий проводник) строго синий (голубой) или бело-синий (бело-голубой).
Если уж мы говорим об обозначениях L и N в электрике, нельзя не отметить еще вот такой знак — , который также, практически всегда можно увидеть совместно с этими двумя маркировками. Таким значком отмечены зажимы, клеммы или контактные соединения для подключения провода защитного заземления (PE – Protective Earthing), он же нулевой защитный проводник, заземление, земля.
Общепринятая цветовая маркировка нулевого защитного провода – желто-зеленый. Эти два цвета зарезервированы только для заземляющих проводов и не встречаются при обозначении фазных или нулевых.
К сожалению, нередко, электропроводка в наших квартирах и домах выполнена с несоблюдением всех строгих стандартов и правил цветовой и буквенно-цифровой маркировки для электрики. И знать предназначение маркировок L и N у электрооборудования, порой, недостаточно, для правильного подключения. Поэтому, обязательно прочитайте нашу статью «Как определить фазу, ноль и заземление самому, подручными средствами?», если у вас есть какие-то сомнения, этот материал будет как нельзя кстати.
И знать предназначение маркировок L и N у электрооборудования, порой, недостаточно, для правильного подключения. Поэтому, обязательно прочитайте нашу статью «Как определить фазу, ноль и заземление самому, подручными средствами?», если у вас есть какие-то сомнения, этот материал будет как нельзя кстати.
что значат эти буквы, какой буквой обозначается заземление
При самостоятельном подключении электрического оборудования – светильников, вентиляции, автомата пользователи могут обнаружить буквенные обозначения клемм. L, N в электрике – это фаза и земля, к которым проводят соответствующие кабели.
Содержание
- Буквенная маркировка проводов
- L – обозначение фазы
- N – буквенный символ нуля
- PE – индекс заземления
- Расцветка изоляционного покрытия проводников
- Цвет жилы заземления
- Цветовое обозначение нулевых рабочих контактов
- Расцветка фазного провода
- Зачем использовать цветовую маркировку
- Нюансы ручной цветовой разметки
- Специфика разметки двухжильного провода
- Разметка трехжильного провода
- Порядок разметки пятипроводной системы
- Как маркировать совмещенные провода
- Расцветка проводки как способ ускорения монтажа
- Требования к расцветке проводки при монтаже
Буквенная маркировка проводов
Стандарты буквенной и цветовой маркировки проводовДля бытовых и промышленных электролиний применяются изолированные провода с внутренними токопроводящими жилами. Изделия отличаются в зависимости от цвета изоляционного покрытия и маркировки. Обозначение фазы и нуля в электрике ускоряет ремонтные и монтажные работы.
Изделия отличаются в зависимости от цвета изоляционного покрытия и маркировки. Обозначение фазы и нуля в электрике ускоряет ремонтные и монтажные работы.
Маркировка кабелей в электрических установках под напряжением до 1000 В регулируется ГОСТ Р 50462-2009:
- в п. 6. 2.1 указывается, что нулевой проводник маркируется как N;
- пункт 6.2.2. гласит, что провод защиты с заземлением обозначается PE;
- в п. 6.2.12 сказано, что в электрике L является фазой.
Понимание маркировки упрощает монтажные работы в хозяйственных, жилых и административных зданиях.
L – обозначение фазы
Обозначение L и N в электрикеВ сети переменного тока под напряжением находится фазный провод. В переводе с английского слово Line имеет значение активный проводник, линия, поэтому маркируется буквой L. Фазные проводники обязательно покрываются цветной изоляцией, поскольку, находясь в оголенном состоянии, могут стать причиной ожогов, травм человека, возгорания или выхода из строя различного оборудования.
N – буквенный символ нуля
Знак нулевого или нейтрального рабочего кабеля – N, от сокращения терминов neutral или Null. При составлении схемы так маркируются клеммы коммутации нуля в однофазной или трехфазной сети.
Слово «ноль» используется только на территории стран СНГ, во всем мире жила называется нейтраль.
PE – индекс заземления
Маркировка заземленияЕсли проводка заземлена, применяется буквенный маркер PE. С английского значение Protective Earthing переводится как провод заземления. Аналогично будут обозначаться зажимы и контакты для коммутации с заземляющим нулем.
Расцветка изоляционного покрытия проводников
Обозначать по цветам кабели заземления, фазы и нуля необходимо в соответствии с требованиями ПУЭ. В документе установлены различия расцветки для заземления в электрощитке, а также для нуля и фазы. Понимание цветового обозначения изоляции исключает необходимость расшифровки буквенных маркеров.
Цвет жилы заземления
На территории РФ с 1 января 2011 года действует европейский стандарт МЭК 60446:2007. В нем отмечено, что заземление имеет только желто-зеленую изоляцию. Если составляется электросхема, земля должна обозначаться как РЕ.
В нем отмечено, что заземление имеет только желто-зеленую изоляцию. Если составляется электросхема, земля должна обозначаться как РЕ.
Жила заземления есть только в кабелях от 3-х жил.
В проводниках PEN, используемых в старых постройках, совмещены жилы земли и нуля. Изоляционное покрытие в данном случае имеет синий цвет заземления и желто-зеленые кембрики на точках соединения и концах провода. В некоторых случаях использовалась обратная маркировка – зануление желто-зеленого цвета с синими наконечниками.
Жилы земли и нуля PEN-кабелей тоньше, чем фазные.
Организация защитного заземления – обязательное условие создания электросети в жилом и промышленном строении. Его необходимость указана в ПУЭ и ГОСТ 18714-81. Стандарты гласят, что нулевое заземление должно иметь наименьший показатель сопротивления. Чтобы не запутаться, используют цветовую разметку кабелей.
Цветовое обозначение нулевых рабочих контактов
Цвет проводов в электропроводкеЧтобы не перепутать, где фаза, а где ноль, вместо букв L и N ориентируются на цвета кабелей. Электрические стандарты отмечают, что нейтраль бывает синего, голубого, сине-белого оттенка вне зависимости от количества жил.
Электрические стандарты отмечают, что нейтраль бывает синего, голубого, сине-белого оттенка вне зависимости от количества жил.
Обозначить ноль можно латинской литерой N, который на схеме читается как минус. Причина прочтения – участие нуля в замыкании электроцепи.
Расцветка фазного провода
Фаза – это токоведущая линия, которая при неосторожном касании может привести к поражению током. У мастеров-новичков часто возникают сложности с поиском кабеля. Обозначается фаза черным, коричневым, кремовым, красным, оранжевым, розовым, фиолетовым, серым и белым оттенком.
Буквенный индекс фазы – L. Он используется там, где провода не размечены цветом. При подключении кабеля к нескольким фазам рядом с литерой L ставится порядковый номер или латинские буквы А, В, С. Фазу также часто маркируют как плюс.
Фазный провод не может быть синим, голубым, зеленым или желтым.
Зачем использовать цветовую маркировку
Определить L и N в электрике можно при помощи индикаторной отвертки.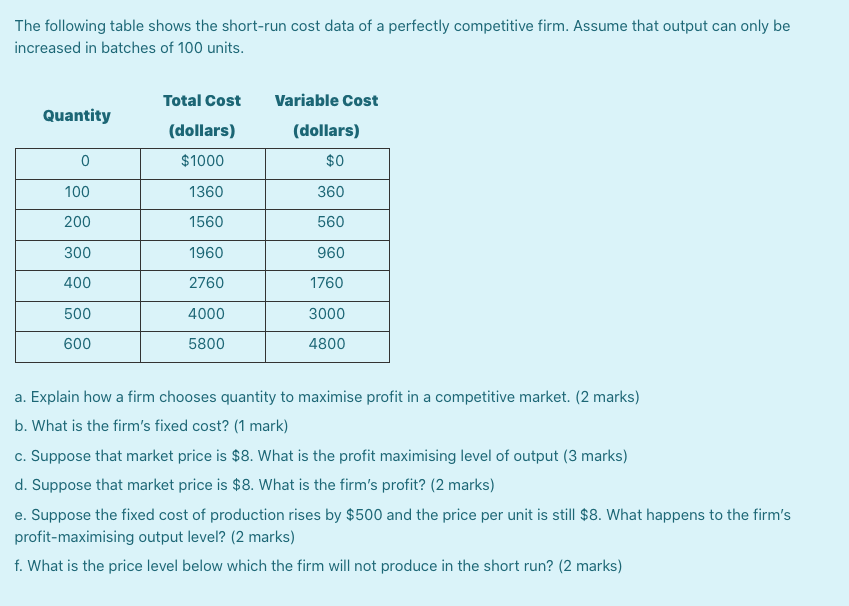 Понадобится прикоснуться кончиком к части изделия без изоляционного покрытия. Свечение индикатора свидетельствует о наличии фазы. Если светодиод не загорелся, жила нулевая.
Понадобится прикоснуться кончиком к части изделия без изоляционного покрытия. Свечение индикатора свидетельствует о наличии фазы. Если светодиод не загорелся, жила нулевая.
Цветовое обозначение сокращает время на поиски нужного провода, устранение неисправности. Знание цветов проводников также исключает риски токового поражения.
Нюансы ручной цветовой разметки
Цветовая маркировка проводов с помощью кембрикаРучная разметка применяется в момент использования проводов одинакового цвета в домах старой застройки. Перед началом работ составляется схема с цветовыми значениями проводников. В процессе укладки помечать токоведущие жилы можно:
- стандартными кембриками;
- кембриками с термоусадкой;
- изоляционной лентой.
Правила допускают использование специальных наборов для маркировки. Точки установки маркеров для обозначения нуля и фазы указаны в ПУЭ и ГОСТе. Это концы провода и места его присоединения к шине.
Специфика разметки двухжильного провода
Термоусадочная трубка для проводовЕсли подключение кабеля к сети уже сделано, можно использовать индикаторную отвертку. Сложность использования инструмента заключается в невозможности определения нескольких фаз. Их понадобится прозванивать мультиметром. Для предотвращения путаницы можно пометить электрический проводник цветом:
Сложность использования инструмента заключается в невозможности определения нескольких фаз. Их понадобится прозванивать мультиметром. Для предотвращения путаницы можно пометить электрический проводник цветом:
- выбрать трубки с термоусадкой или изоленты для обозначения нуля и фазы;
- работать с проводниками не по всей длине, а только на местах соединений и стыков.
Количество цветов определяется схемой. Главное при ее создании – не запутаться, не использовать желтые, зеленые или синие маркеры для фазы. Ее допускается размечать красным или оранжевым цветом.
Разметка трехжильного провода
При помощи мультиметра можно определить расположение фазы, ноля, и заземленияДля поиска фазы, заземления и нуля в трехжильном проводе целесообразно применять мультиметр. Его ставят на режим переменного напряжения и аккуратно щупами касаются фазы, потом – оставшихся жил. Показатели тестера следует записать и сравнить. В комбинации «фаза-земля» напряжение будет меньшим, чем в комбинации «фаза-ноль».
После уточнения линий можно делать маркировку. Понять, фаза – L или N, поможет соответствующая расцветка. У нуля она будет голубой или синей, у плюса – любой другой.
Порядок разметки пятипроводной системы
Электропроводка с трехфазной сети выполняется только пятижильным кабелем. Три проводника будут фазным, один – нейтральным, один – защитным заземлением. Цветовая маркировка применяется согласно нормативным требованиям. Для защиты используется желто-зеленая оплетка, для нуля – синяя или голубая, для фазы – из перечня разрешенных оттенков.
Как маркировать совмещенные провода
Для упрощения процесса монтажа проводки используются кабели с двумя или четырьмя жилами. Линия защиты тут соединяется с нейтралью. Буквенный индекс провода – PEN, где PE обозначает заземляющий, а N – нулевой проводник.
Согласно ГОСТу, используется особая цветовая маркировка. По длине совмещенный кабель будет желто-зеленым, а кончики и точки соединения – синими.
Выделяйте основные точки проблемных мест кембриками или изолентой.
Расцветка проводки как способ ускорения монтажа
Правильная расцветка проводки ускоряет монтаж электропроводкиДо начала действия ГОСТ Р 50462-2009 кабели маркировались белым или черным цветом. Определение фазы и нуля производилось при расключении контролькой в момент подачи питания.
Использование цветовых маркеров упрощает ремонтные работы, обеспечивает их безопасность и удобство. Ориентируясь по оттенку кабелей, мастер не потратит много времени, чтобы провести электричество в дом или квартиру.
Рассмотреть значение цветовой маркировки можно на примере светильника. Если меняется лампа, а ноль и фаза перепутаны, имеются риски травм или летального исхода от поражения током. Когда в электрике обозначение L и N выполнено по цвету, фаза выйдет на выключатель, а ноль – на источник света. Напряжение нейтрализуется, и можно будет касаться даже включенной лампочки.
Требования к расцветке проводки при монтаже
Расключение распредкоробкиОт распредкороба на выключатель протягивается медный провод с одной или двумя жилами. Количество жил зависит от количества клавиш прибора. Разрываться должна фаза, а не ноль. В процессе работы допускается использовать для запитки проводник белого цвета, делая пометку на схеме.
Количество жил зависит от количества клавиш прибора. Разрываться должна фаза, а не ноль. В процессе работы допускается использовать для запитки проводник белого цвета, делая пометку на схеме.
Розетка подключается с учетом полярности. Рабочий ноль будет слева, фаза – с правой стороны. Заземление располагается посередине устройства и зажимается клеммой.
При наличии двух кабелей одинаковой расцветки можно найти фазу и нейтраль при помощи контрольки, индикаторной отвертки, мультиметра.
На электросхеме стоит указывать, что означает L и N, но в электрике их используется несколько. На однолинейной отображена силовая часть – тип питания, количество фаз на потребителя. Здесь целесообразно начертить одну засечку на однофазной сети, три – на трехфазной и указать провода цветом. Коммутационное и защитное оборудование помечается специальными символами.
Правильная маркировка и цветовая разметка проводов обеспечивает качество монтажа и обслуживания линии. Нанесение обозначений согласно международным требованиям позволяет электрикам и домашним мастерам сориентироваться в схеме.
Квантовые числа для атомов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1709
В общей сложности четыре квантовых числа используются для полного описания движения и траекторий каждого электрона внутри атома. Комбинация всех квантовых чисел всех электронов в атоме описывается волновой функцией, удовлетворяющей уравнению Шредингера. Каждый электрон в атоме имеет уникальный набор квантовых чисел; Согласно принципу запрета Паули никакие два электрона не могут иметь одну и ту же комбинацию четырех квантовых чисел. Квантовые числа важны, потому что их можно использовать для определения электронной конфигурации атома и вероятного местоположения электронов атома. Квантовые числа также используются для понимания других характеристик атомов, таких как энергия ионизации и атомный радиус.
Квантовые числа важны, потому что их можно использовать для определения электронной конфигурации атома и вероятного местоположения электронов атома. Квантовые числа также используются для понимания других характеристик атомов, таких как энергия ионизации и атомный радиус.
В атомах существует четыре квантовых числа: главное квантовое число ( n ), квантовое число орбитального углового момента (
Главное квантовое число (\(n\))
Главное квантовое число, \(n\), обозначает основную электронную оболочку. Поскольку n описывает наиболее вероятное расстояние электронов от ядра, чем больше число n , тем дальше от ядра находится электрон, тем больше размер орбитали и тем больше размер атома. n может быть любым положительным целым числом, начиная с 1, так как \(n=1\) обозначает первую основную оболочку (самую внутреннюю оболочку). Первая основная оболочка также называется основным состоянием или состоянием с наименьшей энергией. Это объясняет, почему \(n\) не может быть 0 или любым отрицательным целым числом, потому что не существует атомов с нулевым или отрицательным количеством энергетических уровней/основных оболочек. Когда электрон находится в возбужденном состоянии или получает энергию, он может перейти на вторую основную оболочку, где \(n=2\). Это называется поглощением, потому что электрон «поглощает» фотоны или энергию. Известная как эмиссия, электроны также могут «излучать» энергию, когда они прыгают на более низкие основные оболочки, где n уменьшается на целые числа. С увеличением энергии электрона увеличивается и главное квантовое число, например, 9.0026 n = 3 указывает на третью основную оболочку, n = 4 указывает на четвертую основную оболочку и так далее.
С увеличением энергии электрона увеличивается и главное квантовое число, например, 9.0026 n = 3 указывает на третью основную оболочку, n = 4 указывает на четвертую основную оболочку и так далее.
\[n=1,2,3,4…\]
Пример \(\PageIndex{1}\)
Если n = 7, то какова главная электронная оболочка?
Пример \(\PageIndex{2}\)
Если электрон перепрыгнул с уровня энергии n = 5 на уровень энергии n = 3, произошло ли поглощение или испускание фотона?
- Ответить
Излучение, потому что энергия теряется при испускании фотона.
Квантовое число орбитального углового момента (\(l\))
Квантовое число орбитального углового момента \(l\) определяет форму орбитали и, следовательно, угловое распределение. Количество угловых узлов равно значению квантового числа углового момента \(l\). (Для получения дополнительной информации об угловых узлах см. Электронные орбитали.) Каждое значение \(l\) указывает на конкретную подоболочку s, p, d, f (каждая уникальна по форме). Значение \(l\) зависит от главное квантовое число \(n\). В отличие от \(n\), значение \(l\) может быть равно нулю. Это также может быть положительное целое число, но оно не может быть больше, чем на единицу меньше главного квантового числа (\(n-1\)):
Электронные орбитали.) Каждое значение \(l\) указывает на конкретную подоболочку s, p, d, f (каждая уникальна по форме). Значение \(l\) зависит от главное квантовое число \(n\). В отличие от \(n\), значение \(l\) может быть равно нулю. Это также может быть положительное целое число, но оно не может быть больше, чем на единицу меньше главного квантового числа (\(n-1\)):
\[l=0, 1, 2, 3, 4…, (n-1)\]
Пример \(\PageIndex{3}\)
Если \(n = 7\), какие возможные значения \(l\)?
- Ответить
Поскольку \(l\) может быть нулем или целым положительным числом меньше (\(n-1\)), оно может принимать значения 0, 1, 2, 3, 4, 5 или 6.
Пример \(\PageIndex{4}\)
Если \(l = 4\), сколько угловых узлов имеет атом?
- Ответить
Количество угловых узлов равно значению l , поэтому количество узлов также равно 4.
Магнитное квантовое число (\(m_l\))
Магнитное квантовое число \(m_l\) определяет количество орбиталей и их ориентацию внутри подоболочки. Следовательно, его значение зависит от квантового числа орбитального углового момента \(l\). При заданном \(l\) \(m_l\) представляет собой интервал от \(–l\) до \(+l\), поэтому он может быть нулем, отрицательным целым числом или положительным целым числом.
Следовательно, его значение зависит от квантового числа орбитального углового момента \(l\). При заданном \(l\) \(m_l\) представляет собой интервал от \(–l\) до \(+l\), поэтому он может быть нулем, отрицательным целым числом или положительным целым числом.
\[m_l= -l, (-l +1),(-l +2),…, -2, -1, 0, 1, 2, … (l – 1), (l – 2), +l\]
Пример \(\PageIndex{5}\)
Пример: Если \(n=3\) и \(l=2\), то каковы возможные значения \(m_l\) ?
- Ответить
Поскольку \(m_l\) должен находиться в диапазоне от \(–l\) до \(+l\), тогда \(m_l\) может быть: -2, -1, 0, 1 или 2.
Квантовое число спина электрона (\(m_s\))
В отличие от \(n\), \(l\) и \(m_l\), квантовое число спина электрона \(m_s\) не зависит от другое квантовое число. Он обозначает направление вращения электрона и может иметь спин +1/2, представленный ↑, или -1/2, представленный ↓. Это означает, что когда \(m_s\) положителен, электрон имеет восходящий спин, который можно назвать «спин вверх». Когда он отрицательный, электрон имеет нисходящий спин, поэтому он «спин нисходящий». Значение квантового числа спина электрона состоит в том, что оно определяет способность атома генерировать магнитное поле или нет. (Электронный спин.)
Когда он отрицательный, электрон имеет нисходящий спин, поэтому он «спин нисходящий». Значение квантового числа спина электрона состоит в том, что оно определяет способность атома генерировать магнитное поле или нет. (Электронный спин.)
\[m_s= \pm \dfrac{1}{2}\]
Пример \(\PageIndex{5}\)
Перечислите возможные комбинации всех четырех квантовых чисел, когда \(n=2\), \(l=1\) и \(m_l=0\).
- Ответить
Четвертое квантовое число не зависит от первых трех, что позволяет совпадать первым трем квантовым числам двух электронов. Так как спин может быть +1/2 или =1/2, есть две комбинации:
- \(n=2\), \(l=1\), \(m_l =0\), \(m_s=+1/2\)
- \(n=2\), \(l=1\), \(m_l=0\), \(m_s=-1/2\)
Пример \(\PageIndex{6}\)
Может ли электрон с \(m_s=1/2\) иметь направленный вниз спин?
- Ответить
Нет, если значение \(m_s\) положительное, электрон «раскручивается».

Пристальный взгляд на оболочки, подоболочки и орбитали
Основные оболочки
Значение главного квантового числа n — это уровень главной электронной оболочки (главный уровень). Все орбитали с одинаковым значением n находятся на одном главном уровне. Например, все орбитали на втором главном уровне имеют главное квантовое число n=2. Чем выше значение n, тем больше количество основных электронных оболочек. Это приводит к большему расстоянию между самым дальним электроном и ядром. В результате увеличивается размер атома и его атомный радиус.
Поскольку радиус атома увеличивается, электроны удаляются от ядра. Таким образом, атому легче вытолкнуть электрон, потому что ядро не оказывает на него такого сильного притяжения, и энергия ионизации уменьшается.
Пример \(\PageIndex{7}\)
Какая орбиталь имеет более высокую энергию ионизации: \(n=3\) или \(n=2\)?
- Ответить
- Орбиталь с n=2, потому что чем ближе электрон к ядру или чем меньше атомный радиус, тем больше энергии требуется, чтобы вытолкнуть электрон.

Подоболочки
Количество значений орбитального углового числа l также можно использовать для определения количества подоболочек в главной электронной оболочке:
- Когда n = 1, l = 0 (l принимает одно значение и, таким образом подоболочка может быть только одна)
- Когда n = 2, l = 0, 1 (l принимает два значения и, таким образом, возможны две подоболочки)
- Когда n = 3, l = 0, 1, 2 (l принимает три значения и, следовательно, существует три возможных подоболочки)
После рассмотрения приведенных выше примеров мы видим, что значение n равно количеству подоболочек в основной электронной оболочке:
- Основная оболочка с n = 1 имеет одну подоболочку
- Основная оболочка с n = 2 имеет две подоболочки
- Основная оболочка с n = 3 имеет три подоболочки
Чтобы определить тип возможных подоболочек n, этим подоболочкам были присвоены буквенные имена. Значение l определяет имя подоболочки:
| Название подоболочки | Значение \(л\) |
|---|---|
| подоболочка | 0 |
| р подоболочка | 1 |
| d подоболочка | 2 |
| f подоболочка | 3 |
Следовательно:
- Главная оболочка с n = 1 имеет одну s подоболочку (l = 0)
- Основная оболочка с n = 2 имеет одну подоболочку s и одну подоболочку p (l = 0, 1)
- Основная оболочка с n = 3 имеет одну подоболочку s, одну подоболочку p и одну подоболочку d (l = 0, 1, 2)
Мы можем обозначить главное квантовое число n и определенную подоболочку, комбинируя значение n и имя подоболочки (которое можно найти с помощью l). Например, 3p относится к третьему главному квантовому числу (n=3) и подоболочке p (l=1).
Например, 3p относится к третьему главному квантовому числу (n=3) и подоболочке p (l=1).
Пример \(\PageIndex{8}\)
Как называется орбиталь с квантовыми числами n=4 и l=1?
- Ответить
Зная, что главное квантовое число n равно 4, и используя приведенную выше таблицу, мы можем заключить, что оно равно 4p.
Пример \(\PageIndex{9}\)
- Ответить
3s, 3p и 3d. Поскольку n=3, возможные значения l = 0, 1, 2, что указывает на формы каждой подоболочки.
Орбитали
Количество орбиталей в подоболочке эквивалентно количеству значений, которые принимает магнитное квантовое число ml. Полезным уравнением для определения количества орбиталей в подоболочке является 2l +1. Это уравнение даст вам не значение ml, а число возможных значений, которые может принимать ml на конкретной орбитали. Например, если l=1 и ml может принимать значения -1, 0 или +1, значение 2l+1 будет равно трем и будет три различных орбитали. Названия орбиталей названы в честь подоболочек, в которых они находятся:
Например, если l=1 и ml может принимать значения -1, 0 или +1, значение 2l+1 будет равно трем и будет три различных орбитали. Названия орбиталей названы в честь подоболочек, в которых они находятся:
| s-орбитали | р-орбитали | d-орбитали | f орбитали | |
|---|---|---|---|---|
| л | 0 | 1 | 2 | 3 |
| м л | 0 | -1, 0, +1 | -2, -1, 0, +1, +2 | -3, -2, -1, 0, +1, +2, +3 |
| Количество орбиталей в указанной подоболочке | 1 | 3 | 5 | 7 |
На рисунке ниже мы видим примеры двух орбиталей: p-орбиталь (синяя) и s-орбиталь (красная). Красная s-орбиталь — это 1s-орбиталь. Чтобы изобразить 2s-орбиталь, представьте слой, похожий на поперечное сечение челюсти, вокруг круга. Слои изображают угловые узлы атомов. Чтобы изобразить 3s-орбиталь, представьте еще один слой вокруг круга и так далее и тому подобное. Орбиталь p похожа на форму гантели, ее ориентация внутри подоболочки зависит от m л . Форма и ориентация орбитали зависят от l и m l .
Красная s-орбиталь — это 1s-орбиталь. Чтобы изобразить 2s-орбиталь, представьте слой, похожий на поперечное сечение челюсти, вокруг круга. Слои изображают угловые узлы атомов. Чтобы изобразить 3s-орбиталь, представьте еще один слой вокруг круга и так далее и тому подобное. Орбиталь p похожа на форму гантели, ее ориентация внутри подоболочки зависит от m л . Форма и ориентация орбитали зависят от l и m l .
Чтобы визуализировать и систематизировать первые три квантовых числа, мы можем думать о них как о составных частях дома. На следующем изображении крыша представляет главное квантовое число n, каждый уровень представляет подоболочку l, а каждая комната представляет различные орбитали ml в каждой подоболочке. Орбиталь s, поскольку значение ml может быть только 0, может существовать только в одной плоскости. Однако p-орбиталь имеет три возможных значения ml и, следовательно, три возможные ориентации орбиталей, показанные Px, Py и Pz. Паттерн продолжается: орбиталь d содержит 5 возможных орбитальных ориентаций, а f имеет 7:9. 0024
0024
Еще одним полезным наглядным пособием для рассмотрения возможных орбиталей и подоболочек с набором квантовых чисел будет диаграмма электронной орбиты. (Дополнительные диаграммы электронных орбит см. в разделе « Конфигурации электронов» .) Характеристики каждого квантового числа изображены в разных областях этой диаграммы.
Ограничения
- Принцип исключения Паули: В 1926 году Вольфганг Паули обнаружил, что набор квантовых чисел специфичен для определенного электрона. То есть никакие два электрона не могут иметь одинаковые значения n, l, ml и ms. Хотя первые три квантовых числа определяют конкретную орбиталь и могут иметь одинаковые значения, четвертое имеет значение и должно иметь противоположные спины.
- Правило Хунда: орбитали могут иметь одинаковые энергетические уровни, если они находятся в одной и той же основной оболочке. Эти орбитали называются вырожденными или «равноэнергетическими». Согласно правилу Хунда, электроны заполняют орбитали по одному.
 Это означает, что при рисовании электронных конфигураций с помощью модели со стрелками вы должны заполнить каждую оболочку одним электроном, прежде чем начинать их спаривание. Помните, что заряд электрона отрицательный и электроны отталкиваются друг от друга. Электроны будут пытаться создать расстояние между ним и другими электронами, оставаясь неспаренными. Это также объясняет, почему спины электронов на орбитали противоположны (то есть +1/2 и -1/2).
Это означает, что при рисовании электронных конфигураций с помощью модели со стрелками вы должны заполнить каждую оболочку одним электроном, прежде чем начинать их спаривание. Помните, что заряд электрона отрицательный и электроны отталкиваются друг от друга. Электроны будут пытаться создать расстояние между ним и другими электронами, оставаясь неспаренными. Это также объясняет, почему спины электронов на орбитали противоположны (то есть +1/2 и -1/2). - Принцип неопределенности Гейзенберга: Согласно принципу неопределенности Гейзенберга, мы не можем одновременно точно измерить импульс и положение электрона. По мере того, как импульс электрона становится все более и более определенным, положение электрона становится менее определенным, и наоборот. Это помогает объяснить целые квантовые числа и почему n=2,5 не может существовать как главное квантовое число. Должно быть целое число длин волн (n), чтобы электрон мог поддерживать стоячую волну. Если бы существовали парциальные волны, то целые волны и парциальные волны компенсировали бы друг друга, и частица не двигалась бы.
 Если бы частица покоилась, то ее положение и импульс были бы определенными. Поскольку это не так, n должно иметь целочисленное значение. Дело не в том, что главное квантовое число может быть измерено только целыми числами, а в том, что гребень одной волны будет накладываться на впадину другой, и волна гаснет.
Если бы частица покоилась, то ее положение и импульс были бы определенными. Поскольку это не так, n должно иметь целочисленное значение. Дело не в том, что главное квантовое число может быть измерено только целыми числами, а в том, что гребень одной волны будет накладываться на впадину другой, и волна гаснет.
Ссылки
- Чанг, Рэймонд. Физическая химия для биологических наук. 2005, Университетские научные книги. стр. 427-428.
- Гиллеспи, Рональд. Демистификация вводной химии. Форум: вклад Целевой группы по общей химии. 1996: 73; 617-622.
- Петруччи, Ральф. Общая химия: принципы и современные приложения, десятое издание.
Проблемы
- Предположим, что все, что вы знаете об определенном электроне, это то, что его главное квантовое число равно 3. Каковы возможные значения остальных четырех квантовых чисел?
- Возможно ли иметь электрон с такими квантовыми числами: \(n=2\), \(l=1\), \(m_l=3\), \(m_s=1/2\)? Почему или почему нет?
- Возможно ли иметь два электрона с одинаковыми \(n\), \(l\) и \(m_l\)?
- Сколько подоболочек находится на главном квантовом уровне \(n=3\)?
- Какой тип орбитали обозначается квантовыми числами \(n=4\), \(l=3\) и \(m_l=0\)?
Решения
- Когда \(n=3\), \(l=0\), \(m_l = 0\) и \(m_s=+1/2 \text{ или } -1/2\)
- \(l=1\), \(m_l = -1, 0 или +1\) и \(m_s=+1/2 \text{ или } -1/2\)
- \(l=2\), \(m_l = -2, -1, 0, 1, \text{ или }+2\) и \(m_s=+1/2 \text{ или } -1/ 2\)
- Нет, это невозможно.
 \(m_l=3\) не находится в диапазоне от \(-l\) до \(+l\). Значение должно быть равно -1, 0 или +1.
\(m_l=3\) не находится в диапазоне от \(-l\) до \(+l\). Значение должно быть равно -1, 0 или +1. - Да, возможно иметь два электрона с одинаковыми \(n\), \(l\) и \(m_l\). Спин одного электрона должен быть +1/2, а спин другого электрона должен быть -1/2.
- На главном квантовом уровне \(n=3\) есть три подоболочки.
- Поскольку \(l=3\) относится к подоболочке f, тип представленной орбитали — 4f (комбинация главного квантового числа n и имени подоболочки).
Авторы и авторство
Quantum Numbers for Atoms распространяется под лицензией CC BY-NC-SA 4.0 и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- квантовые числа
Квантовые числа и электронная структура
Квантовые числа и электронная структураКвантовые числа и электронная структура
Таблица квантовых чисел | Слайд-шоу «Структура атома» | Тесты по квантовой химии
Для объяснения поведения электрона в атоме недостаточно
описать электрон просто как отрицательно заряженную частицу; его волнообразный
свойства тоже надо учитывать. Первое такое описание электрона
пришла в 1926 году с развитием волнового уравнения Шредингера. Филиал
наука, занимающаяся решением волновых уравнений, называется квантовой
механика (или волновая механика). Каждое решение волнового уравнения характеризуется
тремя целыми числами, называемыми квантовыми числами. Каждое решение соответствует
дискретной энергии и определяет область пространства вокруг ядра (называемую
орбиталь), где обычно находится электрон с такой энергией. Четвертый
квантовое число также необходимо для уникального описания уравнения.
Четвертый
квантовое число также необходимо для уникального описания уравнения.
Согласно квантово-механической модели разрешенные энергетические уровни электрон состоит из одной или нескольких орбиталей, и распределение электронов относительно ядра определяется количеством и видами энергетических уровней что заняты. Поэтому, чтобы понять, как электроны распределены, мы должны сначала изучить энергетические уровни. Это лучше всего удается через обсуждение четырех квантовых чисел. Наиболее важные аспекты каждого квантового числа представлены ниже.
Главное квантовое число, n . Электронные энергетические уровни
в атоме примерно организованы в основные уровни (или оболочки), как указано
по н. Значение n дает представление о положении электрона в
уровень энергии относительно ядра; чем больше значение n, тем
чем больше среднее расстояние электрона от ядра, тем выше
его энергия. Главное квантовое число может иметь следующие значения: n = 1, 2, 3, 4, . .
.
Азимутальное квантовое число (также называемое вспомогательным или вторичным), л . Каждый главный энергетический уровень может быть разбит на близко расположенные подуровни (или подуровни), как указано в l . Это квантовое число может правильнее назвать квантовым числом формы орбиты, поскольку каждая орбиталь в данном типе подуровня (т. е. заданное значение l ) имеет то же самое форму «электронного облака». Например, когда l = 0, орбиталь сферическая. Для каждого основного энергетического уровня (обозначенного цифрой n ) есть n подуровней (т.е. n значений l ): l =0,1,2,3,( № -1). Подуровни обычно обозначаются буквами. л = 0,1,2,3,4,5, подуровни обозначаются как s , p , г , ж , г ,. подуровней соответственно. Для известных элементов значение l выше 3 (подуровень f ) не требуется.
Два квантовых числа ( n и l ) необходимо указать конкретное
энергетический подуровень.
Магнитное квантовое число, m l . Каждая орбиталь внутри тот или иной подуровень отличается своим значением м л . Это квантовое число может быть более точно названо орбитальным ориентационное квантовое число. В каждом энергетическом подуровне (обозначается l ) существует 2 l +1 возможных независимых ориентаций электронного облака. Каждая ориентация определяется значением ml и называется орбиталью.
м л = л , ( л -1), ( л -2), 0 -( л -2), -( л -1), — л или м л = 0, ±1, ±2, ±3, ± 1
Все орбитали данного подуровня имеют одинаковую энергию (они вырождены). В присутствии магнитного поля их различная ориентация заставляет их иметь разные энергии.
Три квантовых числа ( n , l и м л ) необходимо указать конкретную орбиталь.
Спиновое квантовое число, м с . Электрон вращается
его собственная ось характеризуется м с . Есть два возможных
направления вращения: м с = +1/2 или -1/2. Поскольку спиннинг
заряд создает магнитное поле, электрон имеет магнитное поле, связанное
с этим. Два электрона на одной орбитали наиболее стабильны, когда они
противоположные спины (+1/2 и -1/2) из-за магнитного притяжения. Такие электроны
называются спаренными электронами или магнитными полями друг друга, но неспаренные
электрон может быть обнаружен магнитными измерениями. На самом деле элементы с
неспаренный электрон притягивается магнитными полями; такие элементы называются
парамагнитный. Магнитные измерения показали, что электроны распределены
среди орбиталей подуровня таким образом, чтобы получить максимальное число
неспаренные электроны с параллельными спинами (все м с значения имеют
тот же знак).
Электрон вращается
его собственная ось характеризуется м с . Есть два возможных
направления вращения: м с = +1/2 или -1/2. Поскольку спиннинг
заряд создает магнитное поле, электрон имеет магнитное поле, связанное
с этим. Два электрона на одной орбитали наиболее стабильны, когда они
противоположные спины (+1/2 и -1/2) из-за магнитного притяжения. Такие электроны
называются спаренными электронами или магнитными полями друг друга, но неспаренные
электрон может быть обнаружен магнитными измерениями. На самом деле элементы с
неспаренный электрон притягивается магнитными полями; такие элементы называются
парамагнитный. Магнитные измерения показали, что электроны распределены
среди орбиталей подуровня таким образом, чтобы получить максимальное число
неспаренные электроны с параллельными спинами (все м с значения имеют
тот же знак).
Четыре квантовых числа ( n , l , m l и m s ) необходимы для указания конкретного электрона.
Следующий список представляет собой сжатие наиболее полезной информации. относящиеся к квантовым числам и электронной структуре.
- Четыре квантовых числа:
- n = 1, 2, 3,
- л = 0, 1, 2, 3, . ( н -1)
- м л = 0, ±1, ±2, ±3, ± л
- м с = +1/2 или -1/2
Типы подуровней
QN л
Тип
Орбитали
Всего электронов
QN л Тип Орбиты Всего электронов 0
с
1
2
3 ф 7 14 1
р
3
6
4 г 9 18 2
д
5
10
5 ч 11 22 - Главный энергетический уровень n содержит: (а) n подуровней (б) n 2 орбиталей (в) 2 n 2 электронов максимум
(см.
 таблицу выше)
таблицу выше) - Подуровень l содержит: (а) 2 l +1 орбиталей (б) 2(2 l +1) электронов максимум
- В основном состоянии электроны заполняют орбитали так, что полная энергия атом сведен к минимуму.
- Энергии подуровней увеличиваются по мере: а) увеличения n: 1 с <2 с <3 с ; 2 p <3 p <4 p .. и т. д. (b) l увеличивается: 2 с <2 р ; 3 с <3 р <3 д ; 4 с <4 р <4 д <4 ф ; и т. д.
- Каждая орбиталь может содержать максимум два электрона; они должны быть в паре.
- На данном подуровне электроны распределяются по орбиталям так, как что дает максимальное количество неспаренных электронов с параллельными спинами.
- Для данного значения l форма орбиты остается прежней. Например,
орбитали с l = 0 (1 s , 2 s , 3 s и т.
 д. подуровни)
все сферические.
д. подуровни)
все сферические. - Заданное значение n обозначает определенный главный уровень энергии. Данный значения n и l обозначают определенный энергетический подуровень. Данный значения n , l и m l обозначают конкретное орбитальный. Данные значения n , l , m l , и m s обозначают конкретный электрон.
Чтобы рассмотреть определения и взаимосвязи 4 квантовых чисел, изучить эту таблицу. Тщательное изучение покажет, что таблица соответствует заявления, перечисленные выше.
Количество орбиталей | электронов в подоболочке | ||||
|---|---|---|---|---|---|
| 1 | 0 | 0 | 1с | 1 | 2 |
| 2 | 0 | 0 | 2 с | 1 | 2 |
| 2 | 1 | -1, 0, +1 | 2 шт. | 3 | 6 |
| 3 | 0 | 0 | 3 с | 1 | 2 |
| 3 | 1 | -1, 0, +1 | 3р | 3 | 6 |
| 3 | 2 | -2, -1, 0, +1, +2 | 3д | 5 | 10 |
| 4 | 0 | 0 | 4с | 1 | 2 |
| 4 | 1 | -1, 0, +1 | 4 шт. | 3 | 6 |
| 4 | 2 | -2, -1, 0, +1, +2 | 4д | 5 | 10 |
| 4 | 3 | -3, -2, -1, 0, +1, +2, +3 | 4ф | 7 | 14 |
Существует два распространенных метода указания расположения электронов в
атом. Если не указано иное, состояние с наименьшей энергией (основное состояние)
дано. Этими методами являются электронные конфигурации и диаграммы атомных орбит.
Если не указано иное, состояние с наименьшей энергией (основное состояние)
дано. Этими методами являются электронные конфигурации и диаграммы атомных орбит.
Электронная конфигурация показывает распределение электронов по подуровням с использованием квантовые числа n и l, где l обозначается буквой обозначение ( с , р , д , ф и т.д.). Например, обозначение 3 d 4 указывает на 4 электрона в d подуровень ( l =2) n =3 главного энергетического уровня. Ты ссылается на главу 7 в учебнике, где полное обсуждение электрона конфигурацию можно найти.
Атомная орбитальная диаграмма показывает распределение электронов в атоме с помощью диаграммы, учитывающей распределение по всем четырем квантовым числам.
- Орбиталь изображается прямоугольником, кружком или линией.
- Электрон показан стрелкой.
- Стрелки также показывают спин электрона, так что когда два электрона
находятся на одной орбитали, стрелки указывают в противоположных направлениях, чтобы представить
их противоположные вращения.

- Подуровни показаны обозначением под соответствующими орбиталями (см. примеры ниже).
На рисунке ниже атомная орбитальная диаграмма используется для иллюстрации порядок заполнения первых десяти электронов, как показано введенными числами в коробках. В качестве примера рассмотрим электронную структуру серы.
Поскольку сера имеет 16 электронов, ее электронная конфигурация 1 с 2 2 с 2 2 с 6 3 s 2 3 p 4
| Атомная орбитальная диаграмма серы с двумя неспаренными электронами: |
На приведенной ниже диаграмме показан порядок заполнения орбиты электронами. Помнить
что электроны помещаются на самую низкую доступную энергетическую орбиталь, прежде чем заполнить
на орбиту с более высокой энергией. Кроме того, вы всегда ставите один электрон
на каждой из вырожденных орбиталей определенного энергетического уровня, прежде чем положить
второй электрон на любой из орбиталей той же энергии (правило Хунда).



 Это означает, что при рисовании электронных конфигураций с помощью модели со стрелками вы должны заполнить каждую оболочку одним электроном, прежде чем начинать их спаривание. Помните, что заряд электрона отрицательный и электроны отталкиваются друг от друга. Электроны будут пытаться создать расстояние между ним и другими электронами, оставаясь неспаренными. Это также объясняет, почему спины электронов на орбитали противоположны (то есть +1/2 и -1/2).
Это означает, что при рисовании электронных конфигураций с помощью модели со стрелками вы должны заполнить каждую оболочку одним электроном, прежде чем начинать их спаривание. Помните, что заряд электрона отрицательный и электроны отталкиваются друг от друга. Электроны будут пытаться создать расстояние между ним и другими электронами, оставаясь неспаренными. Это также объясняет, почему спины электронов на орбитали противоположны (то есть +1/2 и -1/2). Если бы частица покоилась, то ее положение и импульс были бы определенными. Поскольку это не так, n должно иметь целочисленное значение. Дело не в том, что главное квантовое число может быть измерено только целыми числами, а в том, что гребень одной волны будет накладываться на впадину другой, и волна гаснет.
Если бы частица покоилась, то ее положение и импульс были бы определенными. Поскольку это не так, n должно иметь целочисленное значение. Дело не в том, что главное квантовое число может быть измерено только целыми числами, а в том, что гребень одной волны будет накладываться на впадину другой, и волна гаснет. \(m_l=3\) не находится в диапазоне от \(-l\) до \(+l\). Значение должно быть равно -1, 0 или +1.
\(m_l=3\) не находится в диапазоне от \(-l\) до \(+l\). Значение должно быть равно -1, 0 или +1.